
- 赖红昌教授
- 上海九院口腔种植科主任
- 口腔种植支持固定修复
- 口腔种植支持活动修复等
上海九院种植牙口腔颅颌面种植科主任,教授、主任医师、博士生导师。现任中华口腔医学会口腔种植专业委员会主任委员,国际口腔种植协会专家委员会委员...[详细]
研究成果
相关文章
不同表面粗糙度种植体周围结扎棉线诱导种植体周围炎的自然发展过程
更新时间:2019-06-27 14:37
不同表面粗糙度种植体周围结扎棉线诱导种植体周围炎的自然发展过程 :一项犬类动物实验研究
Spontaneous progression of ligature induced peri-implantitis at implants with different surface roughness:an experimental study in dogs
莫嘉骥 翻译;赖红昌 审校
关键词 : 牙种植体,组织学,炎症,种植体周围炎,表面粗糙度,钛
摘要
背景 : 种植体周围炎与龈下菌斑的存在、软组织炎症和种植体周围重度骨吸收相关。已有研究使用动物模型模拟了不同时长菌斑堆积后种植体周围炎的进展情况。
目的 : 本实验旨在研究不同表面粗糙度种植体的周围炎症进展情况。
材料和方法 : 在5条比格犬的双侧下颌前磨牙区各植入3颗种植体,一侧植入的是喷砂酸蚀表面(SLA)种植体,另一侧植入的是抛光表面(P)种植体。经过3个月的菌斑控制后用棉线结扎法诱导实验性种植体周围炎,致菌斑堆积直到种植体周围骨吸收达到40%。这个过程大概持续4个月,之后去除棉线,继续任由菌斑自然堆积5个月。分别在实验性种植体周围炎“活动期”的开始和结束时以及全部实验结束时拍摄种植体区域X线片。然后获取并处理样本组织块,制备切片,在光镜下观察并行组织学和形态测量学分析。
结果 : 影像学检查提示两组在实验性种植体周围炎“活动期”开始时骨吸收的量相似,但是去除结线后SLA组的骨吸收进展程度大于P组。组织学检查显示SLA组的骨吸收量和结缔组织炎症病损面积均大于P组。 SLA组种植体表面菌斑面积也大于P组。
结论 : 本研究表明,如果不接受治疗,种植体周围炎在中度粗糙表面种植体上的严重程度将大于光滑表面种植体。
种植体周围粘膜炎和种植体周围炎(Albrektsson & Isidor 1994)是指由位于种植体和周围粘膜之间的菌斑释放毒力因子引起的或是与其相关的一种炎症状态。种植体周围粘膜炎是一种软组织可逆病损 ;而种植体周围炎不仅有粘膜炎症,同时也有骨组织病损,且可进一步损害骨结合。犬类和灵长类动物模型都曾用于描述种植体周围炎发展的机制(例如Lindhe et al. 1992 ; Schou etal. 1992 ; Lang et al. 1993 ; Marinelloet al. 1995 ;综述有Persson 2001)。建立这些动物模型时,使用棉线或者丝线结扎于已经完全骨结合的种植体周围,并将结扎线放置位置调节到粘膜下区域。结扎线危害了种植体周围的粘膜附着,并促进了菌斑的堆积(Lindhe et al. 1992 ; Wetzel etal. 1999)。在结扎线处理的位点,炎症病损快速形成并且骨吸收也快速出现(Lindhe et al. 1992 ; Marinello etal. 1995 ; Persson et al. 1999, 2001)。
从随后的犬类动物实验中发现,在大多数情况下,去除病损位点的结扎线会使种植体周围炎从“活动进展期”进入“静止期”,这样的“静止”性的病损以边界更加局限并且不再发生进一步骨吸收为特征。然而,有些情况下去除结扎线并不能改变炎症进展特征,病损持续发展并最终导致种植体被拔除(Marinello et al.1995)。本研究组近期一项犬类动物实验结果也证实了这一现象(Zitzmann et al. 2004)。我们使用棉线结扎法在21个位点诱导出实验性种植体周围炎。当病损建立后,去除结扎线并继续观察12个月。结果发现,其中16个位点的种植体周围炎继续发展并引起持续的骨吸收。然而,余下的5个位点病损边界变得局限,并没有发生进一步的种植体周围骨破坏。不同位点间去除结扎线后病损进展程度的差异原因还不明确,可能与残余龈下生物膜的成分或是位点周围组织对细菌的不同反应相关。
本实验旨在进一步研究不同表面粗糙度的种植体周围炎症的进展情况。
材料与方法
使用5条3~4岁的比格犬。本研究方案由丹麦哥本哈根动物实验委员会批准。所有下颌前磨牙拔除3个月后,在双侧下颌前磨牙区各植入3颗实心螺纹种植体(ITI牙科种植系统, Straumann,瓦尔登堡,瑞士)(详细步骤参见Gotfredsen et al. 2002)。在其中一侧使用喷砂酸蚀表面(SLA)种植体,而在对侧使用抛光表面(P)种植体。所有种植体都是由商业纯钛制成,直径为3.3 mm,长度为8 mm。表面粗糙度以Sa值表示,并根据Wennerberg &Albrektsson 2000年描述的干涉测量学技术进行评估。抛光表面的种植体的Sa值约为0.35微米, SLA表面的种植体为2.29微米(Sennerby et al. 2005)。依据操作指南植入种植体,使种植体骨内部分和穿龈部分的交界线与牙槽骨嵴顶平齐。愈合2周后,实行菌斑控制方案 :包括每日用牙刷和氯已定凝胶清洁牙齿和种植体。
菌斑控制方案实行3个月后,将定制的持片器(RWT, Kentzler-Kaschner牙科GmbH,埃尔万根,德国)固定到种植体上拍摄X线片。使用显微镜(奥林巴斯SZH10 Research Stereo,奥林巴斯,东京,日本)测量X片中种植体顶部(I)到边缘骨水平(B)的距离(放大7倍)。停止菌斑控制并将棉线结扎于种植体颈部的粘膜下部位(Lindhe et al. 1992)。在接下来的4个月中每2周置换一次结扎线,直至种植体周围骨吸收达到40%时去除结扎线。重新拍摄X线片,并让菌斑继续堆积5个月。在此周期结束时,再次拍摄X线片。使用过量戊巴比妥和固定剂注入颈动脉致死实验犬(Kamovsky1965)。采集下颌骨,并切割成包含种植体和周围软组织的组织块,依据Donath & Breuner(1982)的方式进行磨片。每个组织块制作成2个近远中向切片,切片厚度约20微米(Exakt Apparatebau,诺德施泰特,德国)。切片进行甲苯胺蓝染色。
组织计量学分析
组织学检查通过Leica DM-RBE显微镜(莱卡,韦茨拉尔,德国)和配套的影像系统Q-500MC(莱卡)进行。每张切片进行以下标记用于测量 :种植体周围粘膜的边缘(PM),屏障上皮(结合上皮)或者袋上皮的根方终点(aJE),骨-种植体结合的边缘水平(B),种植体外部顶点(I),炎性浸润的结缔组织根方位置(aICT)和菌斑(aPlaque)。在种植体近中和远中位置测量不同标记点之间的距离。炎症细胞浸润的面积(ICT区域)通过指针标记整个软组织病损范围来评估。此外,由菌斑,结石和脓液(坏死组织和中性粒细胞)占据的软组织以外区域的面积(袋区域)也使用相似的方式进行评估。本分析限定袋区域为种植体周围骨下袋内部分。
数据分析
计算各个变量均值。使用配对t检验对SLA组和抛光种植体组进行比较(n=5)。 P<0.05时差异具有统计学显著性。
结果
临床观察
在菌斑堆积期全部结束后进行临床检查,发现种植体周围聚集大量菌斑和结石。种植体颈部周围的粘膜呈现明显的炎症表象。
影像学测量
在结扎诱导种植体周围炎的4个月中,在SLA和P位点都发生了大量的骨吸收。平均骨吸收在SLA位点是2.51±0.55 mm,在对应的P位点是2.27±1.05 mm (表1,图1和2)。其中4个P位点和4个SLA位点发生的骨吸收大于2 mm。去除结扎线后的5个月中,两组均观察到进一步骨吸收。这期间骨吸收量在SLA位点是1.12±1.07mm,在P位点是0.07±0.72 mm。
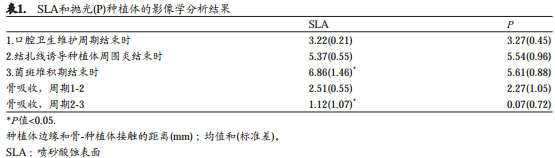
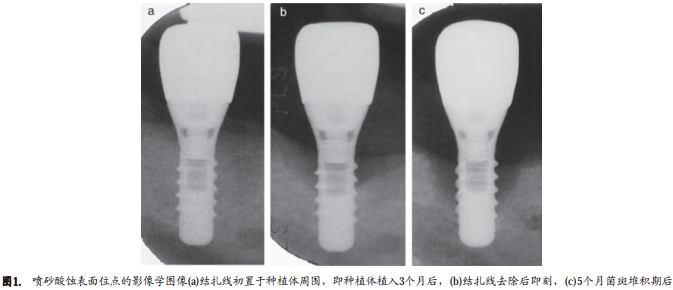
组织学观察
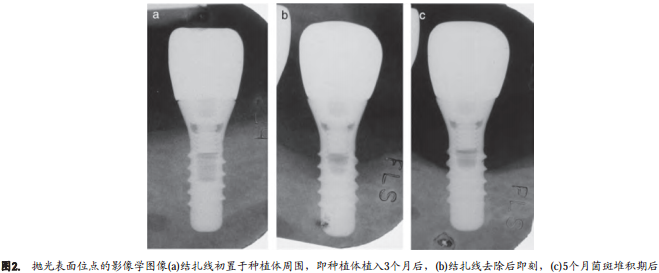
所有样本边缘骨水平均位于种植体骨内段的中三分之一或下三分之一。种植体周围的粘膜出现较大的炎症浸润特征(图3a, b和4a, b)。与此炎性浸润结缔组织(ICT)相邻的种植体表面(P和SLA)由软性矿化的细菌沉积物占据,外层包含中性粒细胞和坏死组织。溃疡化的袋内上皮是种植体周围粘膜(PiM)边缘区域和袋内区域的分界。在病损的根方区域,结缔组织和种植体之间没有上皮屏障。
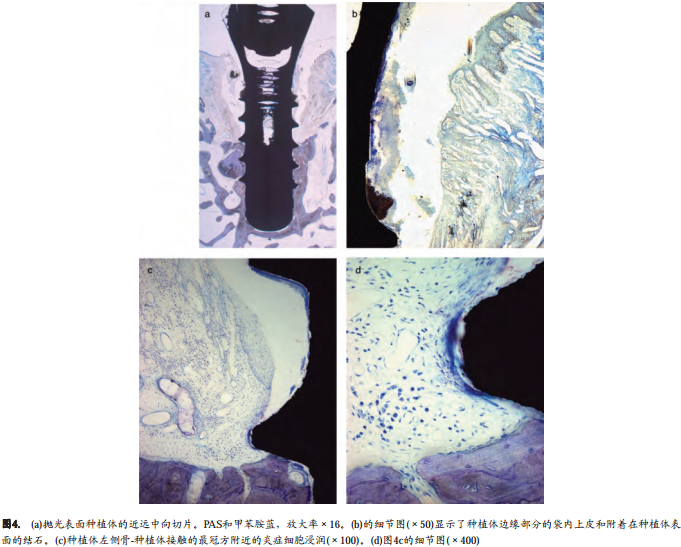
ICT主要由浆细胞组成。中性粒细胞含量也较多。淋巴细胞主要聚集在ICT的上部边缘位置和袋上皮的外侧。上皮内和袋内渗出物中发现中性粒细胞。中性粒细胞也存在于ICT的更外侧部位和远离种植体表面的部位。袋内上皮的ICT根方和邻近种植体表面包含大量的中性粒细胞和血管化结构。这个区域显著缺少胶原和成纤维细胞。
组织计量学发现
平均种植体粘膜高度(PM-B)在SLA位点大于P位点(6.11 vs. 4.5 mm,表2)。袋内上皮长度(PM-aJE)和结缔组织区域(aJE-B)在SLA位点都大于P位点,即3.63vs. 2.81 mm和2.48 vs. 1.69 mm。在SLA位点能比P位点观察到更多的骨吸收量(I-B)(7.34 vs. 5.95 mm),且差异具有统计学显著性。在SLA位点, PM-aICT测量值为5.81±2.69 mm,大约是PiM高度的94%±6%。 P位点相应测量值为3.97±1.04 mm和87%±9%。与P位点相比,SLA位点粘膜下菌斑延伸面积更接近种植体-骨接触边缘(1.17 vs. 1.65 mm)。
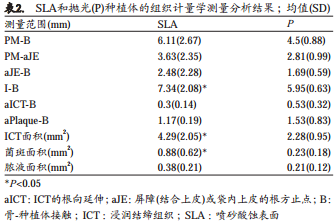
SLA位点ICT面积大于P位点(4.29 vs. 2.28 mm2)。由菌斑和脓液占据的面积在SLA位点(菌斑0.88 mm2,脓液0.38 mm2)也大于P位点(菌斑0.23 mm2,脓液021mm2)。 ICT面积和菌斑面积在两组间有显著性差异。
讨论
本研究分析了不同表面粗糙度(SLA和抛光表面)种植体周围的炎症进展情况。证实两种类型的种植体在“炎症活动期”即结扎线存在时骨吸收量相似。然而,在结扎线去除后的5个月即菌斑自然堆积期,可在SLA种植体周围观察到比抛光种植体周围更大量的骨吸收。组织学检查发现SLA种植体周围骨吸收和结缔组织内炎症病损范围都大于抛光种植体周围。 SLA种植体表面菌斑面积也大于抛光种植体表面。这提示中等粗糙度表面种植体周围炎症进展程度可能比抛光表面种植体更严重。
Albrektsson&Wennerberg(2004)详细定义了种植体表面粗糙度特性。他们参考Wennerberg(1996)提出的Sa值等参数将种植体表面粗糙度分为4组 : “光滑”、 “低度粗糙”、 “中度粗糙”和“粗糙”。 “光滑”表面种植体组(Sa值为0~0.4微米)仅仅包括实验种植体,而“低度粗糙”表面种植体组(Sa值为0.5~1微米)常经过机械切削加工,包括早期的Branemark种植体。 “中度粗糙”表面种植体组的Sa值在1和2微米之间,由SLA种植体等组成,而钛浆喷涂表面是属于“粗糙”表面种植体组(Sa值大于2微米)。在本研究中,使用了抛光种植体和SLA表面种植体。抛光种植体的Sa值为0.35微米,应该属于“光滑”种植体,而SLA表面的Sa值为2.29微米,接近于“中度粗糙”表面种植体的范围。在本文中,需要指出的是,为了避免歧义所使用的光滑种植体表面用“抛光”来表示而不是用“机械加工”。
以往研究常注重比较SLA表面种植体和抛光表面种植体之间不同阶段骨愈合的差异。 Abrahamsson等(2004)使用拉布拉多实验犬研究了SLA表面和光滑表面(与本实验中的抛光表面等同)种植体周围的早期(2小时到12周)骨形成。在他们的实验中,种植体为实心螺纹设计,在螺纹突起之间有着环形凹槽(骨内部分)Berglundh等2003年曾报道了这种环形凹槽起着“伤口愈合室”的作用。有文献报道在SLA表面的“伤口愈合室”中骨-种植体接触面积比抛光表面种植体更大。Persson等(2001)使用比格犬研究了表面粗糙度对于种植体周围炎治疗后愈合过程的影响。此实验设计使用了相似的SLA或者光滑(抛光)表面种植体。在两种类型的种植体都用结扎线成功诱导种植体周围炎。手术治疗包括去除肉芽组织和使用生理盐水浸泡的棉球清洁暴露的钛表面。在6个月愈合期后分析发现,两种类型的种植体周围炎症程度均减轻,并且相邻的骨缺损区域有新骨形成。但SLA表面的二次骨结合量(84%)要大于抛光表面(22%)。 Persson等(2001)认为中度粗糙表面(SLA)在愈合早期有利于血凝块的稳定,进一步促进了二次骨结合。
在Persson等(2001)的研究中,光滑(抛光)表面和中度粗糙表面骨吸收量在结扎线诱导的“炎症活动期”是相似的。这与本研究观察结果一致,提示在结扎线诱导的实验性种植体周围炎阶段,种植体表面粗糙度的影响很小。然而,随着结扎线的去除和菌斑继续堆积,种植体周围炎的进展程度在中度粗糙表面位点比光滑表面更加深入。在去除结扎线后,不仅两种粗糙度表面种植体对菌斑堆积的反应存在显著的差异,不同位点相同粗糙度表面的种植体之间骨破坏也是不同的。Zitman等(2004)也报道了相似结果,他们发现在种植体周围炎的自然发展过程中,不同位点不同个体间的骨吸收也存在差异。他们在拉布拉多实验犬上使用机械切削表面种植体(早期Branemark种植体)诱导了实验性种植体周围炎,并检查了在去除结扎线12个月后骨水平的改变和炎症病损的变化。在去除结线后的菌斑堆积期,炎症病损的破坏在一些位点有所缓解,而在大部分位点发生额外的骨吸收。在Zitzmann等(2004)的研究中,种植体周围的病损与正常组织之间有明显的结缔组织隔离。在本研究中,结扎线去除后5个月即菌斑堆积期结束时,同样能观察到健康的结缔组织存在于ICT和骨组织之间,这个区域的面积在SLA表面组比抛光表面组更小。
参考文献
Abrahamsson, I., Berglundh, T., Linder, E., Lang, N.P. &Lindhe, J. (2004) Early bone formation adjacent to rough and turned endosseous implantsurfaces. An experimental study in the dog. Clinical Oral Implants Research 15: 381–392.
Albrektsson, T. &Isidor, F. (1994) Consensus report of session IV. In: Lang,N.P. &Karring, T., eds. Proceedings of the First European Workshop onPeriodontology, 365–369. London: Quintessence.
Albrektsson, T. &Wennerberg, A. (2004) Oral implant surfaces: part 1 – review focusing on topographic and chemical properties of different surfaces and in vivo responses to them. International Journal of Prosthodontics17: 536–543.
Berglundh, T., Abrahamsson, I., Lang, N.P. & Lindhe, J. (2003) De novoalveolar bone formation adjacent to endosseous implants. Clinical OralImplants Research 14: 251–262.
Donath, K. &Breuner, G.-A. (1982) A method for the study of undecalcifedbones and teeth with attached soft tissues. The Säge-Schliff (sawing andgrinding) technique. Journal of Oral Pathology 11: 318–326.
Gotfredsen, K., Berglundh, T. &Lindhe, J. (2002) Bone reactions at implantssubjected to experimental peri-implantitis and static load. A study in thedog. Journal of Clinical Periodontology 29: 144–151.
Karnovsky, M.J. (1965) A formaldehyde-glutaraldehyde fixative of highosmolarity for use in electron microscopy. Journal of Cell Biology 27:137A–138A.
Lang, N.P., Bra¨gger, U., Walther, D., Beamer, B. & Kornman, K.S. (1993) Ligature-induced peri-implant infection in cynomolgus monkeys. I. Clinical and radiographic fndings. Clinical Oral Implants Research 4: 2–11.
Lindhe, J., Berglundh, T., Ericsson, I., Liljenberg, B. &Marinello, C.P. (1992) Experimental breakdown ofperi-implant and periodontal tissues. A studyin the beagle dog. Clinical Oral Implants Research 3: 9–16.
Marinello, C.P., Berglundh, T., Ericsson, I., Klinge, B., Glantz, P.O. &Lindhe, J. (1995) Resolution of ligature-inducedperi-implantitis lesions in thedog. Journal of Clinical Periodontology 22: 475–479.
Persson, L.G. (2001) Treatment of experimental peri-implantitis lesions.Thesis, Göteborg University, Sweden.
Persson, L.G., Araújo, M.G., Berglundh, T., Gröndahl, K. &Lindhe, J. (1999) Resolution of periimplantitis following treatment. An experimental studyin the dog. Clinical Oral Implants Research 10: 195–203.
Persson, L.G., Berglundh, T., Lindhe, J. &Sennerby, L. (2001) Re-osseointegration after treatment ofperi-implantitis at different implant surfaces. Anexperimental study in the dog. Clinical Oral Implants Research 12: 595–603.
Schou, S., Holmstrup, P., Hjörting-Hansen, E. & Lang, N.P. (1992) Plaque-inducedmarginal tissue reactions of osseointegrated oral implants:a review of the literature. Clinical Oral Implants Research 3: 149–161.
Sennerby, L., Persson, L.G., Berglundh, T., Wennerberg, A. &Lindhe, J.(2005) Implant stability during initiation and resolution of experimentalperiimplantitis: an experimental study in the dog. Clinical Implant Dentistry Related Research 7: 136–140.
Wennerberg, A. (1996) On surfaces roughness and implant incorporation.Thesis, University of Göteborg.
Wennerberg, A. &Albrektsson, T. (2000) Suggested guidelines for the topographic evaluation of implant surfaces. International Journal of OralMaxillofacial Implants 15: 331–344.
Wetzel, A.C., Vlassis, J., Caffesse, R.G., Hämmerle, C.H. & Lang, N.P.(1999) Attempts to obtain reosseointegration following experimentalperi-implantitis in dogs. Clinical Oral Implants Research 10: 111–119.
Zitzmann, N.U., Berglundh, T., Ericsson, I. & Lindhe, J. (2004) Spontaneousprogression of experimentally inducedperiimplantitis. Journal of ClinicalPeriodontology 31: 845–849.



